- Inicio
-
TIENDA
add remove
Categorías
add remove- Salud add remove
- Accesorios add remove
- Juguetes add remove
- Entrenamiento
- Otras especies
- Vestimenta
- Alimento add remove
Legales
add remove - Acerca
- Contacto
CLOREXIDERM SHAMPOO C/350 ML
Referencia: 522881
- Write a review
DESCRIPTION
CLOREXIDERM MAX SHAMPOO
SHAMPOO:
Antiséptico, antiprurítico y reestructurante para perros, gatos y caballos.
INDICACIONES:
Antiséptico con propiedades humectantes y reestructurantes del estrato córneo, auxiliar en el tratamiento de afecciones dermatológicas que cursan con prurito e inflamación (dermatitis, seborrea, etc.) causadas por un amplio espectro de microorganismos susceptibles a la clorhexidina.
VIA DE ADMINISTRACIÓN:
Tópico.
PRESENTACIÓN:
Envase con 350 ml.
INSTRUCCIONES DE APLICACIÓN:
Moje el pelo del animal y aplique cantidad suficiente de shampoo frotando hasta obtener una espuma abundante, deje actuar de 5 a 10 minutos y enjuague. Repita la aplicación 2 veces por semana hasta la remisión de los signos clínicos, posteriormente continúe el uso con la frecuencia del baño usual o como lo indique el Médico Veterinario.
FÓRMULA:
Gluconato de clorhexidina 3g, Alfa-bisabolol 0.1 g, D-pantenol 1 g, Fitoesfingosina HCI 0.05 g.
Vehículo cbp 100 ml.
Clorexiderm Shampoo Antiseptico y Antibacteriano para Perros y Gatos, 350 m
Your comment is submitted

DESCRIPTION
CLOREXIDERM MAX SHAMPOO
SHAMPOO:
Antiséptico, antiprurítico y reestructurante para perros, gatos y caballos.
INDICACIONES:
Antiséptico con propiedades humectantes y reestructurantes del estrato córneo, auxiliar en el tratamiento de afecciones dermatológicas que cursan con prurito e inflamación (dermatitis, seborrea, etc.) causadas por un amplio espectro de microorganismos susceptibles a la clorhexidina.
VIA DE ADMINISTRACIÓN:
Tópico.
PRESENTACIÓN:
Envase con 350 ml.
INSTRUCCIONES DE APLICACIÓN:
Moje el pelo del animal y aplique cantidad suficiente de shampoo frotando hasta obtener una espuma abundante, deje actuar de 5 a 10 minutos y enjuague. Repita la aplicación 2 veces por semana hasta la remisión de los signos clínicos, posteriormente continúe el uso con la frecuencia del baño usual o como lo indique el Médico Veterinario.
FÓRMULA:
Gluconato de clorhexidina 3g, Alfa-bisabolol 0.1 g, D-pantenol 1 g, Fitoesfingosina HCI 0.05 g.
Vehículo cbp 100 ml.
16 otros productos en la misma categoría:
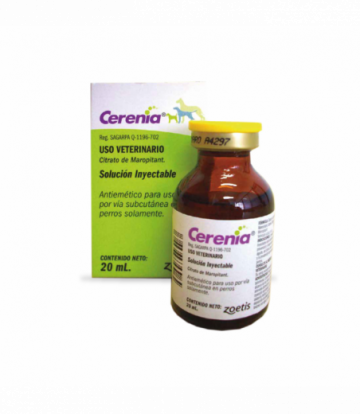
CERENIA INYECTABLE 20 ML
Cerenia (citrato de maropitant) es un medicamento antiemético (contra los vómitos) destinado a la prevención de los vómitos en los perros, incluidos los vómitos causados por el mareo con el movimiento
ALUSPRAY
DESCRIPTION
Aluspray Reg. SAGARPA Q-7090-056
Protector y cicatrizante de heridas
Aluspray® es un protector y doadyuvante de la cicatrización para todo tipo de heridas externas en aerosol tópico.
La fina polvo de Aluspray® sobre la herida asegura que ésta sea cubierta en su totalidad, incluso en heridas irregulares.
Las características de su excipiente le permiten crear una capa hidrofóbica, adherente y sólida a temperatura ambiente que forma una barrera física contra agentes biológicos y físico-químicos; es decir, provee protección contra la suciedad y los insectos disminuyendo los riesgos de infección.
Propiedades
Aluspray® se aplica localmente en forma de aerosol. Esta modalidad de administración permite al polvo de aluminio cubrir por completo todas las irregularidades de las heridas. El aluminio no penetra en las células y permanece a nivel de las membranas, por lo que, las células reducen su permeabilidad pero permanecen viables.
Gracias a sus propiedades astringentes el aluminio posee una acción bactericida. Esta misma particularidad favorece la precipitación de proteínas que forma una capa protectora sobre el área infectada lo que ayuda a reparar el tejido.
El aluminio está directamente involucrado como catalizador en la biosíntesis de colágeno la cual ocurre durante la reparación tisular al sanar heridas. De ahí que, además de actuar como protector, lo haga como cicatrizante.
El polvo de aluminio solo es eficaz en lesiones lavadas y desinfectadas.
Toxicidad
La penetración de cantidades importantes de polvo de aluminio, incluso en la cavidad abdominal, en pequeñas especies no conlleva ninguna consecuencia fisiológica. Retenido en los tejidos por la rápida cicatrización, el polvo de aluminio nunca ha producido una reacción local.
Por vía oral, el aluminio prácticamente no es absorbido y las cantidades eliminadas son idénticas a las cantidades ingeridas. Por lo tanto, incluso en caso de lamido de las heridas, no existe riesgo de acumulación de aluminio a nivel tisular.
El emplear polvo de aluminio ofrece la ventaja de penetrar en las irregularidades e incluso en las fístulas de las heridas.
Aluspray® posee una acción coadyuvante en la cicatrización:
El aluminio micronizado es un potente coadyuvante de la cicatrización como consecuencia de poseer propiedades astringentes
Acelera el proceso de cicatrización y posee una acción antimicrobiana, favoreciendo la eliminación de los gérmenes en los tejidos que cubre
Evita la formación exagera de tejido de granulación especialmente en equinos
El aluminio no atraviesa la membrana celular por lo que no se absorbe y no ejerce efectos tóxicos.
Presentación
Frasco presurizado con 210 ml ( 75 g neto) que contiene 12 g de suspensión activa.
Consulte al Médico Veterinario
No superar la dosis recomendada
Uso veterinario
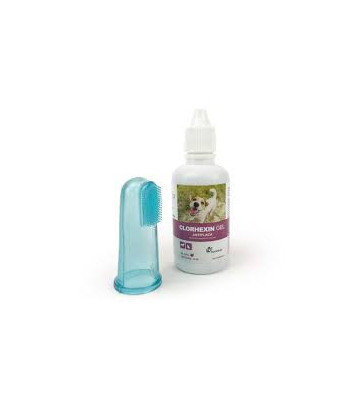
CLORHEXIN GEL
Clorhexin Gel Oral Antiplaca 45 Ml - MederiLab
- Clorhexin Gel para que sirve.
gel oral formulado a base de clorhexidina destinado a la limpieza dental de caninos y felinos. cuenta con un cepillo dental para su fácil aplicación.
fórmula:
|
cada 100 ml contiene: |
|
|
gluconato de clorhexidina |
0.2 mg |
|
vehículo c.b.p. |
100 ml |
indicaciones:
preventivo de la formación de placas de sarro. coadyuvante en el tratamiento de halitosis, periodontitis e infecciones gingivales.
vía de administración:
oral.
dosis:
colocar una cantidad suficiente de gel sobre el cepillo dental. masajee suavemente la encía y los dientes con un movimiento circular.
como tratamiento preventivo se puede iniciar a los 2-3 años de edad. se efectuará una vez por día, 2 veces por semana.
como tratamiento curativo se comenzará luego de la limpieza dental realizándose una vez por día, todos los días. a medida que la evolución sea favorable, se aumentará el intervalo entre aplicaciones hasta 2 veces por semana.
la duración del tratamiento se establecerá a criterio del médico veterinario tratante.
uso veterinario
consulte al médico veterinario
APOQUEL 3.6mg 20 tabletas
DESCRIPTION
apoquel 3.6 mg 20 tabletas
FÓRMULA
Apoquel® 3.6 mg: Cada tableta recubierta con película contiene 3.6 mg de Oclacitinib (como Maleato de Oclacitinib).
INDICADO EN: Perros
Apoquel: un tratamiento de acción rápida, innovador y seguro para el control de prurito canino agudo y crónico.
INDICACIONES: Para el control del prurito asociado con Dermatitis Alérgica y control de la Dermatitis Atópica en perros a partir de los 12 meses de edad.
Dosificación:
- La dosis de los comprimidos de Apoquel es 0.4 a 0.6 mg.
- Apoquel debe ser administrado dos veces al día (BID) hasta por 14 días de terapia y una vez al día (SID) de ahí en adelante para mantenimiento.
- Apoquel puede ser administrado con o sin alimento.
Brinda un inicio del alivio en 4 horas sin muchos de los efectos secundarios comúnmente asociados con esteroides.
Seguro a corto y largo plazoy puede ser usado con muchos medicamentos comunes.
Dirigido de manera única para detener el prurito con un mínimo de impacto negativoen la función inmune.
Permite diagnosticar la causa subyacente y mejorar la calidad de vida del perro y su propietario.
No use Apoquel en perros menores de 12 meses de edad o con infecciones serias.
AMBROXIN 75
DESCRIPTION
FORMULA :
Cada ml contiene:
Amoxicilina Trihidratada ... 75 mg
Bromhexina Clorhidrato .... 2.5 mg
Excipiente c.b.p. ............ 1 ml
Expectorante con antibiótico indicado para el tratamiento de infecciones de las vías respiratorias causadas por bacterias grampositivas y gramnegativas sensibles a la amoxicilina, tales como: Staphylococcus spp, Streptococcus spp, Bordetella bronchiseptica, Pasteurella multocida, Klebsiella spp. Por la combinación con bromhexina se indica en enfermedades que cursen con secreción bronquial donde sea necesario el uso de un mucolitico y expectorante.
Uso en: Caninos.
Presentación: Frasco de 50 ml
CYTOPOINT 30 MG (2 viales)
*****Envío exclusivo CDMX por ser un producto que requiere refrigeración constante*****
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO
CYTOPOINT 10 mg solución inyectable para perros
CYTOPOINT 20 mg solución inyectable para perros
CYTOPOINT 30 mg solución inyectable para perros
CYTOPOINT 40 mg solución inyectable para perros
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Sustancia activa:
Cada vial de 1 ml contiene:
CYTOPOINT 10 mg:
Lokivetmab* 10 mg
CYTOPOINT 20 mg:
Lokivetmab* 20 mg
CYTOPOINT 30 mg:
Lokivetmab* 30 mg
CYTOPOINT 40 mg:
Lokivetmab* 40 mg
*Lokivetmab es un anticuerpo monoclonal caninizado que se expresa a través de técnicas recombinantes en células de ovario de hámster chino (CHO).
Excipientes:
Para la lista completa de excipientes, véase la sección 6.1.
3. FORMA FARMACÉUTICA
Solución inyectable.
El aspecto del medicamento debe ser entre transparente y opalescente sin presencia de partículas visibles.
4. DATOS CLÍNICOS
4.1 Especies de destino
Perros.
4.2 Indicaciones de uso, especificando las especies de destino
Tratamiento de las manifestaciones clínicas de la dermatitis atópica en perros.
4.3 Contraindicaciones
No usar en caso de hipersensibilidad a la sustancia activa o a algún excipiente.
No usar en perros de menos de 3 kg de peso vivo.
4.4 Advertencias especiales para cada especie de destino
Lokivetmab puede inducir la producción de anticuerpos transitorios o persistentes frente al medicamento. La inducción de estos anticuerpos no es frecuente y puede no tener efecto (anticuerpos transitorios) o puede resultar en una evidente disminución de la eficacia (anticuerpos persistentes) en animales que previamente hubieran respondido al tratamiento.
4.5 Precauciones especiales de uso
Precauciones especiales para su uso en animales
En casos de dermatitis atópica, se recomienda investigar y tratar factores causantes de complicaciones, tales como infecciones/infestaciones bacterianas, micóticas o parasitarias (p.ej. pulga, sarna).
Se recomienda monitorizar a los perros para detectar infecciones bacterianas asociadas con dermatitis atópica especialmente durante las primeras semanas de tratamiento.
Si en un mes tras administrar la primera dosis no hay respuesta o esta es limitada, administrar una segunda dosis.Si no existe una mejora en la respuesta del animal un mes después de esta segunda dosis el veterinario debe considerar tratamientos alternativos.
Precauciones específicas que debe tomar la persona que administre el medicamento veterinario a los animales
En caso de autoinyección accidental, potencialmente podrían producirse reacciones de hipersensibilidad, incluyendo anafilaxis.
La autoinyección accidental puede producir una respuesta inmune a lokivetmab. No se espera que esto pueda originar algún efecto adverso, sin embargo, la autoinyección repetida puede aumentar el riesgo de que aparezcan reacciones de hipersensibilidad.
En caso de autoinyección accidental, consulte con un médico inmediatamente y muéstrele el prospecto o la etiqueta.
4.6 Reacciones adversas (frecuencia y gravedad)
En raras ocasiones pueden ocurrir reacciones de hipersensibilidad (anafilaxia, edema facial, urticaria). En estos casos se debe administrar inmediatamente un tratamiento apropiado.
La frecuencia de las reacciones adversas se debe clasificar conforme a los siguientes grupos:
- Muy frecuentemente (más de 1 animal por cada 10 presenta reacciones adversas durante un tratamiento)
- Frecuentemente (más de 1 pero menos de 10 animales por cada 100)
- Infrecuentemente (más de 1 pero menos de 10 animales por cada 1.000)
- En raras ocasiones (más de 1 pero menos de 10 animales por cada 10.000)
- En muy raras ocasiones (menos de 1 animal por cada 10.000, incluyendo casos aislados).
4.7 Uso durante la gestación, la lactancia o la puesta
No ha quedado demostrada la seguridad del medicamento veterinario durante la gestación y la lactancia; por tanto, su uso no está recomendado durante la gestación, la lactancia o en animales reproductores.
4.8 Interacción con otros medicamentos y otras formas de interacción
No se han observado interacciones farmacológicas en las pruebas de campo en las que lokivetmab se administró de forma concomitante con medicamentos veterinarios como endo y ectoparasiticidas, antimicrobianos, antiinflamatorios y vacunas.
Si se administra(n) otra(s) vacuna(s) al mismo tiempo que el tratamiento con lokivetmab, esta(s) debería(n) ser administrada(s) en una zona diferente.
4.9 Posología y vía de administración
Vía subcutánea.
Evitar agitar excesivamente o la formación de espuma en la solución. Administrar la totalidad del contenido del vial (1 ml).
Dosificar de acuerdo a la siguiente tabla de dosificación. Para perros con un peso superior a 40 kg, se requiere el contenido de más de un vial para administrar una única dosis. En esos casos, retirar el contenido apropiado de cada vial dentro de una misma jeringa. Para conseguir la mezcla de la solución, invertir suavemente la jeringa 3 o 4 veces antes de la administración.
Dosificación y esquema de tratamiento:
La dosis mínima recomendada es de 1 mg/kg peso vivo, una vez al mes. Dosificar de acuerdo a la siguiente tabla de dosificación:
Concentración (mg) de CYTOPOINT a administrar
Peso vivo del perro (kg) 10 20 30 40
3,0-10,0 1 vial
10,1-20,0 1 vial
20,1-30,0 1 vial
30,1-40,0 1 vial
40,1-50,0 1 vial 1 vial
50,1-60,0 2 viales
60,1-70,0 1 vial 1 vial
70,1-80,0 2 viales
4.10 Sobredosificación (síntomas, medidas de urgencia, antídotos), en caso necesario
En estudios de sobredosificación realizados en laboratorio, no se han observado otras reacciones adversas diferentes a las mencionadas en la sección 4.6.
En caso de aparición de signos clínicos adversos tras una sobredosificación, el perro debería ser tratado sintomáticamente.
4.11 Tiempo(s) de espera
No procede.
5. PROPIEDADES INMUNOLÓGICAS
Grupo farmacoterapéutico: Otras preparaciones dermatológicas. Agentes para la dermatitis, excluyendo corticosteroides.
Código ATCvet: QD11AH91
Lokivetmab es un anticuerpo monoclonal caninizado (mAb) específicamente dirigido a la interleuquina canina IL-31. El bloqueo de IL-31 por lokivetmab previene la unión de IL-31 a su co-receptor y por tanto, inhibe la señal celular mediada por IL-31 proporcionando alivio del prurito asociado a la dermatitis atópica y actividad antiinflamatoria.
En un modelo de estudio de laboratorio, lokivetmab demostró un inicio de la eficacia frente al prurito en el primer punto de toma de datos a las 8 horas postratamiento.
En estudios de campo, de hasta 9 meses de duración, el tratamiento de perros con dermatitis atópica demostró un efecto favorable en la reducción del prurito y de la gravedad de la enfermedad evaluada mediante el Índice de Extensión y la Gravedad de la Dermatitis Atópica Canina (CADESI) 03. Un pequeño número de perros mostró ausencia o baja respuesta clínica al lokivetmab. Probablemente esto es debido al mecanismo de acción múltiple de lokivetmab en el contexto de una enfermedad compleja y una patogenia heterogénea. Ver también la sección 4.5. del RCP.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Histidina
Hidrocloruro de histidina monohidrato
Dihidrato de trealosa
Edetato de disodio
Metionina
Polisorbato 80
Agua para preparaciones inyectables.
6.2 Incompatibilidades
No mezclar con ningún otro medicamento veterinario.
6.3 Período de validez
Período de validez del medicamento veterinario acondicionado para su venta: 2 años.
Período de validez después de abierto el envase primario: Uso inmediato.
6.4. Precauciones especiales de conservación
Conservar en nevera (entre 2ºC y 8ºC).
No congelar.
Conservar en el embalaje original.
Proteger de la luz.
6.5 Naturaleza y composición del envase primario
Acondicionamiento primario: Vial de vidrio claro tipo I monodosis cerrado con tapón de goma de fluorobutilo.
Acondicionamiento secundario: Caja de cartón.
Formatos:
CYTOPOINT 10 mg solución inyectable para perros:
Caja de cartón con 2 viales de 1 ml
Caja de cartón con 6 viales de 1 ml
CYTOPOINT 20 mg solución inyectable para perros:
Caja de cartón con 2 viales de 1 ml
Caja de cartón con 6 viales de 1 ml
CYTOPOINT 30 mg solución inyectable para perros:
Caja de cartón con 2 viales de 1 ml
Caja de cartón con 6 viales de 1 ml
CYTOPOINT 40 mg solución inyectable para perros:
Caja de cartón con 2 viales de 1 ml
Caja de cartón con 6 viales de 1 ml
Es posible que no se comercialicen todos los formatos.
6.6 Precauciones especiales para la eliminación del medicamento veterinario no utilizado o, en su caso, los residuos derivados de su uso
Todo medicamento veterinario no utilizado o los residuos derivados del mismo deberán eliminarse de conformidad con las normativas locales.
7.TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Zoetis Belgium SA
Rue Laid Burniat 1
1348 Louvain-la-Neuve
BÉLGICA
8.NÚMERO(S) DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/2/17/205/001-008
9.FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LAAUTORIZACIÓNFecha de la primera autorización: 25/04/2017
10.FECHA DE LA REVISIÓN DEL TEXTO
Encontrará información detallada sobre este medicamento veterinario en la página web de la Agencia Europea de Medicamentos (http://www.ema.europa.eu/).